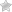Pneumocystis carinii
Пневмоцистоз, являясь причиной заболеваемости и летальных исходов у 65-85% больных СПИДом, относится к наиболее важным и значимым СПИД-индикаторным инфекциям.
До эпидемии СПИДа, pneumocystis carinii был известен прежде всего как этиологический фактор оппортунистической инфекции, развивающейся у людей с врожденными или приобретенными иммунодефицитными состояниями (включая пациентов, получающих химиотерапию, реципиентов почечных трансплантатов, детей с недостаточностью белкового питания).
В настоящее время инфекция, вызванная p. carinii, преимущественно встречается у больных СПИДом. Заболевание чаще всего проявляется в виде пневмоцистной пневмонии.
Pneumocystis carinii – микроорганизм с циклом жизни, подобным toxoplasma gondii. Возбудитель имеет характерную микроструктуру с внутриклеточными тельцами, типичными для protozoa. Однако изучение последовательностей рибосомальной РНК показывает наиболее вероятную родственную связь с saccharomyces.
Возбудитель пневмоцистоза — pneumocystis carinii — внеклеточный паразит многих видов животных, которого отличает строгий тропизм к легочной ткани.
Весь жизненный цикл пневмоцисты проходит в альвеоле (рис.1). Вегетативная форма пневмоцисты — трофозоит — прикрепляется к эпителию легкого, выстланного альвеолоцитами i порядка. Физиологический контакт паразита с клетками хозяина осуществляется через систему микропиноцитозных пузырьков.
Спорозоит — представлен клетками овальной формы (2-3 мкм), окружёнными слизистой капсулой.
После инвазии в ткани лёгкого спорозоиты дифференцируются в трофозоиты — плеоморфные клетки с тонкой клеточной оболочкой.
Размножается делением; капсула делится в последнюю очередь, предварительно образуя перетяжку и разделяясь на две особи. При окраске по Романовскому-Гимзе окрашиваются в фиолетовый цвет, ядра — в тёмно-синий.
После ряда делений некоторые трофозоиты вступают в спорогонию (половой цикл размножения): паразитарное тельце увеличивается, заполняя всю цитоплазму, формируется стенка цисты, и ядро вступает в цикл последовательных делений. Образуется циста (диаметром 5-8 мкм), содержащая 8 спорозоитов.
Рисунок 1. Жизненный цикл pneumocystis carinii При разрыве цисты высвобождаются спорозоиты, дающие при благоприятных условиях начало популяции трофозоитов. Предцисты и зрелые цисты с внутрицистными тельцами находятся в просвете альвеол, в составе пенистого экссудата (рис. 2 – 6).
Рисунок 2. Предцисты и зрелые цисты с внутрицистными тельцами находятся в просвете альвеол, в составе пенистого экссудата. Окраска – silver methenamine
Рисунок 3. Предцисты и зрелые цисты с внутрицистными тельцами находятся в просвете альвеол, в составе пенистого экссудата.
Окраска – silver methenamine
Рисунок 4. Предцисты и зрелые цисты с внутрицистными тельцами находятся в просвете альвеол, в составе пенистого экссудата. Окраска – silver methenamine
Рисунок 5. Электронная микроскопия цисты. Видны nucleus и mitochondria
Рисунок 6. Электронная микроскопия цист, находящихся на различных стадиях развития
Патогенез пневмоцистной инфекции определяется механическим повреждением интерстициальной выстилки легкого как самим паразитом, так и воспалительными клетками: стенки альвеол инфильтрируются мононуклеарами, клетки интерстиция — плазматическими клетками.
Толщина альвеолярной стенки увеличивается в 5-20 раз против нормальной; повреждение сурфактанта приводит к ослаблению растяжимости альвеол при длительной экскурсии.
Вследствие этих процессов развивается альвеолярно-капиллярный блок, приводящий к тяжелой аноксии и смерти больных от нарастающей дыхательной недостаточности.
Пневмоцистная пневмония (Пп) послужила основанием для диагностики первых 5 случаев СПИДа, описанных в 1981 г., и натолкнула клиницистов на мысль о возможном этиологическом агенте, вызывавшем иммунодефицит у ранее здоровых молодых людей-гомосексуалистов Лос-Анжелеса.
Эта инфекция стала в дальнейшем наиболее частым СПИД-ассоциируемым заболеванием. Решающее значение Пп для прогноза течения СПИДа способствовало значительной интенсификации исследований иммунобиологии и патогенеза данной инфекции.
У паразитов были обнаружены антигенные детерминанты, идентичные эпитопам некоторых человеческих тканей. Антигенной мимикрией часто объясняют широко распространенное пневмоцистоносительство.
Нарушения в клеточных и гуморальных звеньях иммунитета при СПИДе приводят к переходу из латентной к манифестной форме пневмоцистной инфекции. Пп у больных СПИДом развивается медленно, исподволь. От начала продромальных явлений до появления основных легочных симптомов проходит 4 нед.
и более, лихорадка и одышка выражены нерезко, постепенно усиливается непродуктивный кашель. Кроме «легочной» формы пневмоцистной инфекции у больных СПИДом иногда обнаруживаются внелегочные поражения (например, пневмоцистные поражения печени, кожи, кишечника, щитовидной железы и др.).
Диагноз Пп у больных СПИДом не представляет таких сложностей, какие встречаются при подозрении Пп у больных с иммунодефицитными состояниями другой этиологии. Необычная легкость диагностики связана с «заведомо» предполагаемой причиной появившихся у больного с ВИЧ-инфекцией дыхательных расстройств. Однако найти самого возбудителя оказывается достаточно сложно.
Существует 4 показателя, по которым диагноз Пп может предполагаться у больного с ВИЧ-инфекцией: 1) повышение СОЭ > 50 мм/час; 2) повышение ЛДГ > 220 me; 3) выявление молочницы или волосатоклеточной лейкоплакии; 4) обнаружение на рентгенограммах диффузных интерстициальных изменений, распространяющихся от корней к периферии.
Необходимость выявления указанных показателей связана с минимальной информацией, получаемой при объективном осмотре. Что касается важности рентгенологических исследований грудной клетки, то при Пп информация от этого метода диагностики существенно меньше, чем при других видах пневмоний.
Хотя у 75% больных СПИДом с Пп на рентгенограммах определяются диффузные интерстициальные инфильтраты (рис. 7), аналогичные изменения могут наблюдаться и при цитомегаловирусной (ЦМВ) пневмонии, и при атипичном микобактериозе, и при гистоплазмозе. У 5-10% больных не определяется никаких изменений на рентгенограммах грудной клетки, даже при явной клинике Пп.
Наконец, у 30-35% больных наблюдаются чрезвычайно затрудняющие диагностику атипичные признаки.
Описываются следующие атипичные находки при пневмоцистозе у больных СПИДом: 1) асимметричные инфильтраты, в некоторых случаях инфильтраты были преимущественно периферической или двусторонней латеральной локализации; 2) лобарные или сегментарные инфильтраты; 3) локализация легочного процесса в верхних отделах легких, что требует дифференциального диагноза с туберкулезом легких; 4) единичные легочные узлы; 5) у 7% больных отмечаются тонкостенные «кистозоподобные образования», не заполненные фибрином или жидкостью.
Рисунок 7.Диффузные билатеральные интерстициальные инфильтраты в легком у больного СПИДом
Паразитологическое исследование является основным методом верификации диагноза. Считается, что пневмоцисты могут быть обнаружены в альвеолярно-бронхиальном секрете, мокроте из гортани, глотке и даже в желудочном содержимом, однако содержание пневмоцист в перечисленном материале крайне неодинаковое. Эффективность исследования материала, взятого из гортани и глотки, очень низкая (5-15%). Для исследования берут либо самостоятельно отходящую мокроту, либо мокроту, полученную с помощью ингаляции. Более эффективно исследование мокроты после ингаляции, при аспирации ее с помощью бронхоскопа. Было установлено, что при первых двух способах количество цист в препарате бывает небольшим (3-6 в мазке), в то время как при последнем способе их количество существенно большее (до 50 цист в мазке). Из этого следует, что нахождение в мазке мокроты даже единичных цист при наличии соответствующих клинических симптомов может быть расценено как верификация диагноза.
Еще более надежным является исследование лаважной (промывной) жидкости (87%). Эта жидкость получается при инсталляции в дистальные отделы бронхиального дерева теплого физиологического раствора с последующей его аспирацией. Аспират может быть разделен на 3 порции: бронхиальный, бронхоальвеолярный и альвеолярный.
Исследованию может быть также подвергнут биоптат, полученный при трансбронхиальной, чрескожной, аспирационной или открытой биопсии легкого. Наилучшие результаты получаются при открытой биопсии легкого (100%). Этот метод приравнивается к хирургическому вмешательству, хотя состояние больных, как правило, не позволяет к нему прибегнуть.
В то же время с помощью этого метода получается достаточно большой объем материала, и ложно-отрицательный результат исследования исключается. Достаточно эффективные методы лабораторного культивирования pneumocystis carinii пока не разработаны. Серологические методы диагностики также мало эффективны. Антитела часто обнаруживаются у здоровых людей.
Диагноз обычно устанавливается на основании цитологического исследования бронхоальвеолярного лаважа или ткани легкого, полученного путем трансбронхиальной биопсии при бронхоскопии. Зрелые формы p. carinii содержат до восьми спорозоитов. При разрыве пневмоцисты спорозоиты освобождаются, превращаются в трофозоиты и цикл повторяется.
Материал для микроскопии обычно окрашивают gomori methenamine silver (gms), cresyl violet, или toluidine blue. В срезах ткани легкого пневмоцисты идентифицируются по окраске клеточной стенки. Лучший результат получается при окраске gms. gms окраска дает более контрастное изображение тканевых срезов и мазков. Микроорганизмы имеют темно-коричневый или черный цвет.
Пневмоцисты обычно группируются по 5-7 образований. Они имеют округлую или эллиптическую форму иногда с заостренным концом с центральной затемненной обрастью (рис. 9-12).
Рисунок 9. Схематический рисунок P. carinii (окраска по методу GMS и Гимза)
Рисунок 10. GMS окраска P. carinii в ткани легкого
Рисунок 11. Трофозоиты и цисты в бронхоальвеолярном лаваже.
Окраска по Гимзе (Giemsa)
Рисунок 12. Цисты, содержащие спорозоиты. Окраска по Гимзе (Giemsa) Для диагностики пневмоцистоза используют также иммунофлюоресцентные, иммуногистохимические методы. В последние годы все более широко начинает применяться метод цепной полимеразной реакции.
Для лечения пневмоцистоза у больных СПИДом предложено много препаратов с многочисленными схемами ведения больных. Такая разнообразная лечебная стратегия объясняется частотой побочных эффектов, которые развиваются у больных, ослабленных самой ВИЧ-инфекцией, вследствие чего терапию пневмоцистоза часто приходится прерывать.
Наиболее длительно применяющимся для лечения Пп препаратом является пентамидин. Дозировки пентамидина не отличаются от таковых у больных без ВИЧ-инфекции, однако частота побочных эффектов значительно выше — 45%.
Побочные эффекты развиваются в среднем через 10,4 дня (от 6 до 16 дней): анемия, нейтропения, гипонатриемия, повышение уровня креатинина, почечная недостаточность, брадикардия, панкреатит, гипогликемия или гипергликемия. Для предотвращения указанных эффектов предложено проведение ингаляций пентамидина по 600 мг на 1 ингаляцию. Курс — 21 день.
При таком введении препарата отмечено только появление кашля и бронхоспазма, который обычно легко купируется бронходилятаторами. Однако часть исследователей считает, что ингаляционная терапия пентамидином способствует возникновению ранних рецидивов пневмоцистоза, чаще отмечаются внелегочные поражения и спонтанный пневмоторакс.
Такие осложнения связаны зачастую с неправильным выбором размера частиц для ингаляций. Если частицы ингаляционной смеси имеют диаметр 10 мкм они оседают или в ротоглотке или в верхних дыхательных путях, оптимальным же является размер частиц до 1-2 мкм в диаметре.
Терапия бисептолом больных СПИДом с Пп также представляет большие трудности из-за частых (45-50%) случаев развития побочных осложнений: 1) сыпь; 2) тошнота/рвота; 3) анемия; 4) нейтропения. Наиболее часто осложнения появляются через 11,5 дней от начала терапии, обычно прекращаются после прерывания лечения.
К препаратам резерва относится дапсон, который назначают по 100 мг перорально в течение 21 дня. В связи с меньшей эффективностью, чем первые два препарата (61%) его не рекомендуют для лечения тяжелых форм пневмоцистоза. Предпочтителен курс лечения дапсоном в сочетании с триметопримом: 100 мг дапсона + 20 мг/кг/день триметоприма (в 4 дозах), курс — 21 день.
Эффективность лечения 1 эпизода значительно выше, чем при лечении только дапсоном и составляет около 100%. Основным побочным эффектом от сочетания этих препаратов является развитие гемолиза у больных с дефицитом глюкозо-6-фосфат-дегидрогеназы. Так как эти два препарата обладают взаимоактивирующим действием, побочные эффекты от их сочетания также выше.
Среди других значимых осложнений терапии отмечена метгемоглобинурия, при появлении которой препараты необходимо отменять, а больному следует назначить в/в 1-2 мг/кг метиленовой сини.
Применение механической вентиляции легких оценивается неоднозначно: большинство исследователей считают ее применение ненужным и даже противопоказанным из-за снижения сроков выживания у многих больных.
В отличие от больных Пп на фоне иммунодефицитных состояний, у больных СПИДом Пп — одна из основных причин летальных исходов, после первого эпизода пневмоцистоза средний период выживания около 9,7 мес. Через 6 мес. после первого эпизода у 18% больных развиваются рецидивы болезни. Более 60% больных СПИДом имеют не менее 2 рецидивов в течение 12-18 мес.
после первого эпизода болезни. В связи с этим чрезвычайно актуальной является проблема профилактики инфекции. Различают первичную химиопрофилактику, которую назначают больным с риском развития пневмоцистоза (с содержанием cd4 < 200/мм ) и вторичную, для больных, уже перенесших пневмоцистоз. Для первичной химиопрофилактики используют атовахон в дозе 300 мг в мес. или бисептол (по 480 мг/день или по 960 мг/день). Высоко оценивается интермиттирующая химиопрофилактика бисептолом по 960 мг х 3 в нед. по сравнению с ежедневным приемом: в первом случае в 2,4 раза реже развиваются побочные осложнения, чем во втором.
Профилактика. Основной этап — раннее выявление и изоляция больных. Общие мероприятия аналогичны таковым при прочих респираторных инфекциях.
Назад
Источник: https://medic.pnzgu.ru/page/15705
Пневмоцистоз – маркер віл-інфекції
Пневмоцистна пневмонія є рідкісною формою запалення легенів. Хворіти такій пневмонією можуть люди, які мають ослаблений імунітет: недоношені і ослаблені діти, люди з важкими імунними патологіями, лейкозом, туберкульозом.
Але найчастіше запалення легенів, викликане пневмоцистами (пневмоцистоз), розвивається у хворих на туберкульоз ВІЛ / СНІДом. Присутність вірусу імунодефіциту в організмі людини послаблює його імунну систему, зокрема клітинний імунітет, даючи можливість безконтрольно розвиватися тим мікроорганізмам, які при нормальному імунітеті людини розвиватися не можуть.
Епідеміологія і механізм розвитку пневмоцистної пневмонії
Пневмоцисти – це дріжджоподібні грибки класу Blastomycetes. Пневмоцисти дуже широко поширені в природі, як серед тварин, так і серед людей. Однак мікроорганізми, що мешкають в легенях тварин, значно відрізняються за розмірами від людських. Це означає, що зараження людини від тварин неможливо – воно походить від людей, які хворіють на пневмоцистозом або носіїв.
Пневмоцисти мають виражену тропність (прихильністю) до легеневої тканини. Паразити облюбували альвеоли легенів, оскільки протягом всього циклу розвитку вони мають потребу у великій кількості кисню.
Потрапляють пневмоцисти в людські легені повітряно-крапельним шляхом з пилом, крапельками слини і слизу, але розвиватися при нормальному рівні імунітету вони не можуть, тому знаходяться в пасивному стані – у вигляді цист. Є дані про вертикальному шляху передачі пневмоцист – від ВІЛ-інфікованої матері плоду.
Пневмоцистна пневмонія виникає при різкому ослабленні загального і місцевого бронхопульмональной імунітету, коли критично знижується кількість альвеолярнихмакрофагів – легеневих імунних клітин. На фоні зниженого імунітету кількість пневмоцист за час інкубаційного періоду (від 4 до 12 тижнів) може вирости з 10 тисяч до 1 мільярда клітин.
Пневмоцистна пневмонія є одним із маркерів при ВІЛ-інфекції. Експериментально доведено, що ймовірність виникнення цієї форми пневмонії при ВІЛ обернено пропорційна вмісту CD4 + лімфоцитів (Т-клітин) в крові хворого, що можна визначити лабораторними діагностичними тестами.
При зниженні імунітету у людини, зараженого пневмоцистами, відбувається вивільнення мікроорганізмів з цист і прикріплення їх до стінок альвеолоцитов (клітин, з яких побудовані стінки альвеол). Розвиваючись в альвеолах, пневмоцистами розмножуються і обсеменяются все нові і нові ділянки легких.
В процесі своєї життєдіяльності паразити ушкоджують альвеолярні стінки, приводячи до розвитку реактивного інтерстиціального набряку. Набряклі стінки альвеол значно зменшують їх просвіт, ускладнюючи відтік ексудату з них. У заповнених альвеолах порушується газообмін.
Для побудови стінок нових клітин пневмоцисти використовують фосфоліпіди і протеїни, що входять до складу сурфактанту легенів господаря.
Сурфактант служить для захисту альвеол легенів від спадання в момент видиху, коли з них виштовхується повітря. Без сурфактанту легені не можуть функціонувати.
Тому, щоб компенсувати виниклу брак цієї речовини, людський організм починає посилено його продукувати, але новий сурфактант знову використовується паразитами для своїх цілей.
В результаті в просвіті альвеол у великій кількості накопичується «браковане» сурфактантної речовина у вигляді піни. До складу цієї альвеолярної піни, крім залишків сурфактанту, також входять токсичні речовини, що виділяються грибками в процесі життєдіяльності.
Клінічні прояви
Пневмоцистна пневмонія при ВІЛ розвивається з поступовим наростанням симптоматики. Найчастіше початок захворювання співпадає з настанням холодної погоди, оскільки в цей період імунітет сезонно слабшає. Інкубаційний період пневмоцистозу триває близько 4 тижнів, але іноді може затягуватися до 8-12 тижнів і більше.
При аналізі газового складу крові визначається гіпоксемія (зниження рівня кисню в крові) і респіраторний алкалоз (підвищення рН за рахунок газів крові).
Через 2-3 тижні від початку захворювання приєднуються грипоподібні симптоми. При прогресуванні запалення легенів протягом декількох наступних тижнів симптоматика наростає і з`являються:
- Задишка – один з ранніх ознак пневмоцистної пневмонії. Спочатку вона з`являється при помірному фізичному навантаженні, а через кілька тижнів – і в спокої;
- Сухий кашель, переважно в денний час. Пізніше кашель стає постійним, з`являється в нічний час. Під час кашлю починає відходити невелика кількість мокротиння;
- Болі за грудиною, які з`являються або посилюються при вдиху. Щоб не допустити посилення больових відчуттів, хворі усвідомлено обмежують глибину дихальних рухів, що робить дихання поверхневим і підсилює ознаки гіпоксії.
У зв`язку з неспецифічними проявами, поступовим наростанням симптоматики і затяжним перебігом пневмоцистну пневмонію часто визначають вже в запущеній формі.
Об`єктивно визначається втрата ваги, блідість шкірних покривів з синюшностью носогубного трикутника, шкіри пальців ніг і рук, почастішання пульсу. При пальпації шкіри грудної клітини можна визначити підшкірну емфізему (скупчення повітря в підшкірній жировій клітковині).
При вираженому иммунодефицитном стані спостерігається генералізація пневмоцистной інфекції – осередки з пінним вмістом утворюються в печінці, нирках, серці, центральній нервовій системі і інших органах, куди пневмоцисти потрапляють гематогенним (через кров), лімфогенним (по лімфатичних судинах) або контактним шляхом (з легких на сусідні органи).
При аускультації грудної клітини над легкими можуть прослуховуватися хрипи (сухі, пізніше – вологі). Крепітація, характерна для пневмококової пневмонії, при аускультації пневмоцістозних легеньвислуховується рідко, тому часто вводить в оману терапевтів.
Для діагностики пневмоцистної пневмонії при ВІЛ-інфекції застосовують:
- загальний аналіз крові;
- біохімічний аналіз крові (газовий склад, лактатдегидрогеназа);
- рентгенографію;
- мікроскопію мокротиння або промивних вод бронхів (пневмоцисти виявляються рідко);
- імунологічне дослідження крові (виявлення антитіл до пневмоцист в крові) – іммунофореза, ІФА (імуноферментний аналіз);
- імунологічний аналіз харкотиння (виявлення антигенів пневмоцист в матеріалі) – РИФ (реакція імунофлуоресценції), ПЛР (полімеразна ланцюгова реакція).
В загальному аналізі крові виявляються неспецифічні ознаки гострого запалення і загального виснаження:
Для профілактики і лікування пневмонії наші читачі активно застосовують Монастирський збір отця Георгія. Збір має вкрай високою ефективністю в лікуванні захворювань органів дихання. Складається з натуральних лікарських рослин і трав, які ростуть в екологічно чистих гірських районах.
Надає загальнозміцнюючий і оздоровчий ефект – захищає організм в целом.Чітать докладніше …
- анемія;
- підвищення загальної кількості лейкоцитів (до 20-50 × 109/ Л);
- підвищення кількості еозинофілів (до 15-25%);
- підвищення ШОЕ (до 50 мм / год і більше).
На рентгенограмі при пневмоцистної запаленні легенів виявляються:
- посилення легеневого малюнка від коренів до периферії;
- вогнища підвищеної легкості;
- смазанность легеневого малюнка – «симптом матових стекол»,« Симптом пластівців снігу ».
Постановка діагнозу пневмоцистної пневмонії певні складнощі, оскільки при цій патології немає специфічних симптомів.
На цей діагноз при ВІЛ-інфекції наштовхує тільки:
- невідповідність аускультативной картини тяжкості дихальної недостатності;
- рентгенологічні ознаки;
- рівень CD4 + лімфоцитів в крові (˂ 200 клітин в мкл).
Хорошим діагностичним критерієм є імунологічні методи дослідження крові та мокротиння.
Лікування і профілактика захворювання
Лікування ВІЛ-інфікованих хворих з пневмоцистної пневмонією проводять виключно в боксах або напівбоксах, щоб мінімізувати контакт цих хворих з іншими пацієнтами або родичами.
Основним напрямком в лікуванні цих пневмоній у ВІЛ-інфікованих є антибактеріальні препарати, що володіють властивістю пригнічувати розмноження пневмоцист:
- Бактрим або Бісептол (комбінація сульфаметоксазолу і триметоприму), які блокують ферменти системи фолієвої кислоти у мікроорганізмів.
- Пентамідин, який пошкоджує репродуктивну систему пневмоцист.
Ці препарати є високотоксичними:
- порушують функцію печінки і підшлункової залози;
- пригнічують кровотворення;
- можуть знижувати рівень кальцію і підвищувати вміст азотистих речовин в крові;
- впливають на рівень глюкози в крові.
Спочатку призначається одне із зазначених лікарських засобів, але якщо по закінченню тижня позитивної динаміки не спостерігається – його замінюють іншим.
Останнім часом в лікуванні ВІЛ-асоційованої пневмоцистної пневмонії віддають перевагу препарату ДФМО (діфторметілорнітін). Це лікарський засіб, крім впливу на розмноження пневмоцист, також перешкоджає розмноженню вірусів, в тому числі ВІЛ. Лікування цим препаратом повинно бути тривалим (не менше 8 тижнів).
Прогноз при пневмоцистної пневмонії у ВІЛ-інфікованих при відсутності відповідного лікування несприятливий: хворі в 100% випадків гинуть. Якщо діагноз був встановлений вчасно, то пневмоцистна пневмонія у пацієнтів з ВІЛ-інфекцією протікає щодо сприятливо. Так, при своєчасному лікуванні летальність пацієнтів знижується до 25%, при пізньому лікуванні – до 40%.
Набагато гірше прогноз при рецидив пневмоцистної пневмонії, оскільки часто у пацієнтів розвиваються сильні побічні реакції на Пентамідин і Бактрим. Летальність при рецидивах збільшується до 60%.
Щоб пневмоцистна пневмонія не виникла, ВІЛ-інфікованим пацієнтам з низькою кількістю CD4 + лімфоцитів проводять хіміопрофілактику. Розрізняють первинну і вторинну хіміопрофілактику у таких пацієнтів:
- Первинна хіміопрофілактика призначається при рівні CD4 + лімфоцитів менше 200 клітин в мкл. Хворим з четвертою стадією ВІЛ-інфекції (стадією розгорнутого СНІДу) хіміопрофілактику призначають довічно.
- Вторинна хіміопрофілактика передбачає призначення препаратів для попередження рецидиву пневмоцистозу.
Крім медикаментозної профілактики, ВІЛ-інфікованим пацієнтам слід також дотримуватися і інші запобіжні заходи:
- підвищити кількість білкової їжі в своєму раціоні;
- часто провітрювати і щодня проводити вологе прибирання житлових приміщень;
- регулярно обстежуватися у лікаря, повідомляти йому про найменші зміни в стані здоров`я.
Тільки чітке виконання всіх рекомендацій лікаря-спідолога, регулярне обстеження і лікування виникають захворювань можуть продовжити життя пацієнта з ВІЛ-інфекцією і поліпшити її якість.
Поділися в соціальних мережах:
Источник: https://uaetrobve.ru/health/1320-pnevmocistoz-marker-vil-infekcii.html
Вич маркерные заболевания
Пневмоциста – возбудитель респираторного заболевания легких, которое встречается у людей из группы риска. Данное заболевание не характерно для здоровых людей, так как возбудитель является условно-патогенным.
Распространенность пневмоцистной пневмонии среди населения невелика, но среди людей с первичными иммунодефицитными состояниями эта патология весьма часто встречается: у больных на лейкозы, лимфогранулематоз, другие онкопатологии, при врожденных иммунодефицитах, а также при ВИЧ-инфицировании.
У пациентов со СПИДом пневмоцистоз является «маркером» заболевания и встречается более, чем у половины инфицированных.
Pneumocystis carinii – микроорганизм, который был выделен у больного человека с дыхательных путей в бронхах в месте бифуркации (карины), от чего и произошло название этого вида.
Данный возбудитель в естественных условиях живет в легких многих животных, а также у некоторых людей, от которых и происходит заражении. Путь инфицирования – воздушно-капельный.
Однако люди с нормальным иммунным статусом могут не болеть, а быть лишь носителями, поскольку пневмоциста является условно-патогенной. При иммунодефицитных состояниях развиваются клинические симптомы заболевания.
При изучении строения этого микроорганизма было много дискуссий по поводу того, к какому Царству отнести данный вид. Особенности строения РНК, митохондрий, белковых структур мембраны позволяли классифицировать как Грибки, но отсутствие эргостерола и особенности жизненного цикла подтверждают, что пневмоциста является Наипростейшим.
Структура пневмоцисты не так уж и проста. Это связано с непостоянством строения клеточных элементов вследствие сложного клеточного цикла. Размеры простейшего варьируют от 1 до 10 микрометров, в зависимости от стадии цикла. Поэтому по микроскопом могут различные формы – от мелких форм с тонкой клеточной стенкой до крупных с более толстой стенкой.
Пневмоциста принадлежит к внеклеточным паразитам и локализируется главным образом в альвеолоцитах первого и воторого порядка. Микроорганизм может существовать в четырех основных формах: трофозоит, прециста, циста и спорозоит.
Трофозоит – это форма существования, которая характеризуется значительным диаметром клетки и неправильной формой. Оболочка толстая и имеет выросты в форме псевдоподий, поэтому форма трофозоита непостоянная.
Эти структуры предназначены для тесного контакта возбудителя с альвеолоцитарной клеткой. Внутри клетки – цитоплазма с характерными для многих микроорганизмов органеллами: митохондрии, рыбосомы, вакуоли с клеточным соком и липидные и углеродные компоненты.
Ядро занимает достаточно места и окружено двумя мембранами для защиты генетического материала.
Прецисты имеют овальную форму без выростов, небольшие размеры и тонкую клеточную мембрану. В середине этих структур ядра деляться с образованием цист.
Цисты также округлой формы, но их размеры больше, так как внутри содержатся специальные тельца – предшественники спорозоита. Цисты имеют оболочку и толстую трехслойную мембрану, которая после разрыва имеет неправильную форму и таким образом цикл повторяется.
Размножается пневмоциста путем простого деления генетического материала надвое, а затем делиться и содержимое цитоплазмы с оболочкой.
Пневмоциста является позаклеточным паразитом, но вместе с тем, различные формы существования позволяют проникать и внутрь клетки. Заражение происходит воздушно-капельным путем.
В организм человека попадает циста, которая при достаточном иммунном ответе обезвреживается иммунокомпетентными клетками. Если нет, то циста растет и продолжает свой цикл развития дальше с образованием зрелых форм.
Весь цикл можно разделить на две фазы – половую и неполовую.
Жизненный цикл пневмоцисты достаточно сложный и проходит поэтапно несколько жизненных форм: трофозоит, прециста, циста, спорозоит.
Трофозоит является вегетативной формой, которая прикрепляется к альвеолоциту своими псевдоподиями и тесно взаимодействует с клеточной мембраной.
Затем путем клеточного деления образовывается две зрелые клетки, и таким образом происходит размножение. Это так называемая неполовая фаза развития пневмоцисты.
Из трофозоита образовывается прециста, которая имеет огромное ядро и сосредоточенные вокруг него питательные вещества необходимые для будущей цисты.
Когда проходит время, ядро делится и образовывается циста, которая имеет внутри чаще всего 8 ядер. Из цисты выходят микроорганизмы – спорозоиты.
Они имеют одинарный набор генетической информации, а когда сливаются между собой, то получается снова трофозоит, и цикл развития снова повторяется. Это половая фаза развития.
Цисты, когда попадают в организм человека, локализируются на альвеолах. При интенсивном размножении трофозоитов и цист становится все больше и альвеолоциты десквамируются, тогда возникают клинические проявления. Первые иммунные реакции на этот процесс развиваются за счет клеточного иммунитета.
Макрофаги и Т-хелперы реагируют на чужеродные агенты и пытаются фагоцитировать их, но цисты имеют способность находиться внутри макрофага и не подвергаться действию его лизосомальных ферментов. Поэтому клеточной иммунной реакции недостаточно для комплексного иммунного ответа и элиминации пневмоцисты.
Когда запускается с помощью каскадных механизмов под влиянием Т-хелперов гуморальное звено иммунитета, то иммуноглобулины поражают трофозоиты и зараженные макрофаги.
Вот почему, у людей с патологией иммунного ответа это заболевание развивается очень быстро, ведь для адекватной защиты необходим хороший уровень как местного клеточного, так и гуморального иммунитета.
Инкубационный период заболевания составляет от одной недели до пяти. Это зависит от возраста и от степени иммуносупрессии организма. Часто заболевание может протекать по типу обычного острого респираторного заболевания, тогда клинические признаки выражены слабо и человек может умереть на фоне легкого течения.
Учитывая морфологические изменения в легких, выделяют несколько клинических стадий:
- стадия отека – возникает во время начала инфильтрационных изменений и характеризуется симптомами интоксикации, нарастания дыхательных нарушений.
- стадия ателектаза – нарушение оттока секрета из альвеол способствует их склеиванию и развитию ателектаза легких.
Клинически появляется кашель, усиливается дыхательная недостаточность.
- стадия эмфиземы – длится неопределенное время, что зависит от эффективности лечения. Симптомы уменьшаются, но остаточные явления в легких в виде эмфизематозных булл дают коробочный звук при перкуссии.
Симптомы пневмоцистной пневмонии отличаются у взрослых и детей. Дети могут заболеть в случае недоношенности, патологии центральной нервной системы, перинатальных повреждениях, внутриутробных инфекциях. Заболевание в таком случае развивается на 3-4 месяц жизни ребенка.
Тогда ребенок теряет в весе, отказывается от груди, нарушается его сон, появляются симптомы отдышки и периоральный цианоз. Ребенок кашляет по типу коклюша иногда с выделением мокроты пенистого характера.
На рентгенограмме могут быть изменения по типу интерстициальных инфильтратов или по типу «облачных» легких.
У взрослых клинические признаки развиваются через неделю после инфицирования, в случае пациентов, получающих лечение имунодепресантами, и через 2-3 месяца у больных на СПИД.
Заболевание начинается с повышения температуры до субфебрильных цифр, умеренного кашля, одышки при физической нагрузки и боли в области грудной клетке. Через неделю в случае отсутствия лечения симптомы усиливаются, появляется цианоз, высокая температура.
Тяжелое течение заболевания обусловлено быстрым диффузным распространением воспаления на оба легких. Это усиливает дыхательную недостаточность и на фоне общей иммуносупрессии опасно отеком легких.
У ВИЧ-инфицированных особенности пневмоцистоза – вялое развитие симптомов заболевания, что часто способствует фульминантному течению с летальным исходом. Поэтому у больных на СПИД есть определенные показания к началу профилактического лечения пневмоцистной пневмонии, даже если особенных клинических проявлений нет.
Учитывая тот факт, что симптомы пневмоцистной пневмонии не являются специфическими и часто заболевание протекает без выраженных клинических явлений, но с фульминантным течением – этиологическая верификация в данном случае очень важна для своевременного лечения.
Клинические проявления не являются патогномоничными, поэтому по данным анамнеза и объективного обследования доктор может определить только наличие пневмонии, а ее характер трудно заподозрить.
Важным фактом анамнеза является наличие у пациента онкопатологии, лечения цитостатиками, ВИЧ-инфицирования. Это позволяет заподозрить именно этот вид пневмонии на фоне значительного снижения реактивности иммунитета. Поэтому важно такой контингент больных очень тщательно исследовать и проводить профилактические меры.
Поэтому лабораторные и инструментальные методы диагностики – ведущие в верификации диагноза.
Рентгенография легких – обязательный метод диагностики и подтверждения пневмонии. Характерные изменения – это явление «белого легкого» или «облачного легкого», но эти симптомы не так часто встречаются и на начальных стадиях эти изменения еще не развиваются. У детей пневмоцистоз может выражаться на рентгенограмме по типу интерстициальной пневмонии.
Бронхоскопию рекомендуют проводить для получения смыва с бронхов и дальнейшего исследования секрета.
Пневмоцисты в мокроте могут выявляться при значительном их количестве в альвеолах. Исследование мокроты является одним из достоверных методов верификации диагноза. Материалом для исследования кроме мокроты может быть бронхо-альвеолярный смыв.
Используют микроскопический метод с окрашиванием материала по Романовскому-Гимзе, и при этом выявляются фиолетовые клетки с красным ядром. Но этот метод не всегда дает результат, поскольку под объектив микроскопа могло не попасть достаточное количество возбудителя. Более точный метод – паразитологический.
Материал, полученный от больного, высевают на живительную среду и за несколько дней вырастает возбудитель, что подтверждает диагноз.
Данные методы редко используются в современных условиях, поскольку до получения результата проходит много времени, а также необходима лаборатория с оборудованием, что есть не в каждом медицинском учреждении. Поэтому в данное время распространены методы серологической диагностики.
Анализ на качественное определение пневмоцист можно проводить с исследованием не только мокроты, но и крови. Используют метод полимеразной цепной реакции – молекулярно-генетический метод, основанный на выявлении ДНК в материале больного.
Более простой серологический метод исследования (исследование сыворотки крови) – выявление антител к пневмоцистам. Так как на возбудителя вырабатываются иммуноглобулины, то их уровень или наличие свидетельствует об активности процесса.
Определяют уровень иммуноглобулинов класса G и М методом иммуноферментного анализа или имунофлюоресцентным методом.
Повышенный уровень иммуноглобулинов класса М свидетельствует об острой инфекции, а при повышении иммуноглобулинов G – возможна длительная хроническая инфекция.
Лечение данного заболевания представляет осложненную задачу, поскольку антибиотики не действуют на возбудителя. Кроме того, лечение необходимо начинать как можно заранее и только специфическое. Перед началом терапии следует определить тяжесть заболевания, что характеризуется степенью дыхательной недостаточности по уровню парциального давления кислорода в крови.
Этиологическим лечением пневмоцистоза является применение сульфаметоксазола/триметоприма – бисептола. При легком течении назначают пероральный прием препарата или внутривенные инфузии в дозе 100 мг/кг и 20 мг/кг соответственно.
Однако учитывая у пациентов наличие сопутствующего иммунодефицита, эти препараты вызывают много побочных эффектов: кожная сыпь, анемия, лейкопения, агранулоцитоз, тошнота, диспепсические проявления.
Поэтому оптимальный курс лечения – 2 недели.
При тяжелом течении к этому препарату добавляют Пентамидин – препарат, который имеет специфическое действие, так как повреждает репродукционные системы пневмоцист. Его применяют в дозе 4 мг/кг при разведении в 5% глюкозе. Курс лечения 2-3 недели.
Это только этиотропная терапия, но используют также симптоматически жаропонижающие средства, дезинтоксикационную терапию, регидратацию, противогрибковые препараты и антибиотики для ВИЧ-инфицированных.
Профилактика пневмоцистоза необходима по причине сложности заболевания и осложненного течения его у контингента больных. Методы профилактики могут быть неспецифические и специфические – медикаментозные.
Неспецифические методы профилактики характеризуются проведением обследования больных из группы риска в случае эпидемиологических показаний, а также корректная и правильная антиретровирусная терапия у больных СПИДом.
Для таких людей имеет большое значение правильный режим дня, достаточное питание, исключение вредных привычек.
Специфические методы профилактики – это использование этиотропных медикаментозных средств. Используют для профилактики те же препараты, что и для лечения. Показанием к такой первичной профилактике является уровень клеток СD4 ниже 300, так как это считается уровень риска поражения пневмоцистой.
Пневмоциста – возбудитель весьма сложного заболевания, которое, не имея специфических клинических признаков, необходимо диагностировать на начальной стадии и назначить правильное лечение, так как последствия могут быть очень серьезные.
Пневмоцистоз развивается у людей с первичными или вторичными иммунодефицитами и эти состояния взаимоотягощающие.
Поэтому у определенных групп больных необходимо профилактировать это заболевание как специфическими, так и неспецифическими методами.
Портнов Алексей Александрович
Образование: Киевский Национальный Медицинский Университет им. А.А. Богомольца, специальность – “Лечебное дело”
Микробы хорошие и плохие – Джессика Снайдер Сакс. 2013
Медицинская микробиология, вирусология и иммунология – Воробьев А.А. 2004
Клиническая микробиология – Донецкая Э.Г.-А. 2011
Медицинская микробиология, вирусологии и иммунология – В.В. Зверев, М.Н. Бойченко – Учебник в 2-х томах. 2010
Портал о человеке и его здоровой жизни iLive.
ВНИМАНИЕ! САМОЛЕЧЕНИЕ МОЖЕТ БЫТЬ ВРЕДНЫМ ДЛЯ ВАШЕГО ЗДОРОВЬЯ!
Информация, опубликованная на портале, предназначена только для ознакомления.
Обязательно проконсультируйтесь с квалифицированным специалистом, чтобы не нанести вред своему здоровью!
Источник: http://life4well.ru/ukho-gorlo-nos/lor-organy/107163-vich-markernye-zabolevaniya